Unsur-unsur dalam golongan yang sama memiliki elektron valensi yang sama. Demikian pula unsur-unsur pada periode yang sama, elektron valensinya menghuni orbit yang sama. Oleh karena sifat-sifat unsur ada hubungannya dengan konfigurasi elektron maka unsur-unsur dalam golongan yang sama akan memiliki sifat yang mirip dan dalam periode yang sama akan menunjukkan sifat yang khas secara berkala (periodik) dari logam ke nonlogam. Beberapa sifat periodik unsur di antaranya adalah jari-jari atom, afinitas elektron, energi ionisasi, dan keelektronegatifan.

1. Jari-jari Atom
Jari-jari atom sangat kecil, diduga diameternya sekitar 10–10 m. Satuan yang biasa digunakan untuk menyatakan jari-jari atom adalah angstrom (Å). Satu angstrom sama dengan 10–10 m.
Jari-jari atom didefinisikan sebagai setengah jarak antara dua inti atom yang berikatan dalam wujud padat (perhatikan Gambar 2.5). Hasil pengukuran ditunjukkan pada Tabel 2.3. Jika Anda perhatikan Tabel 2.3 maka akan terlihat adanya keteraturan jari-jari, baik dalam golongan yang sama maupun dalam periode yang sama. Perhatikanlah jari-jari atom dari atas ke bawah dalam golongan yang sama. Apakah yang dapat Anda simpulkan mengenai jari-jari atom dalam golongan yang sama? Bertambahnya jari-jari atom dari atas ke bawah dalam golongan yang sama disebabkan bertambahnya orbit (lintasan) elektron. Bertambahnya orbit menyebabkan volume atom mengembang sehingga jari-jari atom meningkat.
Perhatikanlah jari-jari atom dari kiri ke kanan dalam periode yang sama. Apakah yang dapat Anda simpulkan mengenai jari-jari atom dalam periode yang sama?
Penurunan jari-jari atom dari kiri ke kanan dalam periode yang sama disebabkan bertambahnya jumlah proton di dalam inti atom, sedangkan jumlah orbitnya sama. Dengan bertambahnya jumlah proton, tarikan inti terhadap elektron valensi makin kuat sehingga terjadi pengerutan volume atom. Akibatnya, jari-jari atom dari kiri ke kanan mengecil (perhatikan Gambar 2.6).
2. Energi Ionisasi
Energi ionisasi adalah energi yang diperlukan untuk mengeluarkan elektron valensi dari suatu atom atau ion dalam wujud gas.
Nilai energi ionisasi bergantung pada jarak elektron valensi terhadap inti atom. Makin jauh jarak elektron valensi terhadap inti atom, makin lemah tarikan inti terhadap elektron sehingga energi ionisasi makin kecil. Nilai energi ionisasi unsur-unsur utama ditunjukkan pada Gambar 2.7 yang digambarkan secara grafik.
Gambar 2.7 Grafik energi ionisasi pertama unsur-unsur golongan utama
Pada periode yang sama, dari kiri ke kanan jari-jari atom relatif tetap, tetapi muatan inti bertambah. Hal ini menyebabkan tarikan inti terhadap elektron valensi makin besar. Bagaimanakah kecenderungan energi ionisasi jika diurutkan dari kiri ke kanan pada periode yang sama?
Selain muatan inti atom, energi ionisasi juga dipengaruhi oleh konfigurasi elektron, terutama konfigurasi elektron dengan jumlah elektron valensi sebanyak 8 (golongan VIIIA, gas mulia). Perhatikan grafik pada Gambar 2.7, pada setiap periode, energi ionisasi terbesar dimiliki oleh unsur-unsur gas mulia (He, Ne, Ar, Kr, dan Xe). Unsurunsur
gas mulia adalah contoh unsur-unsur paling stabil. Kestabilan ini disebabkan atom-atom gas mulia memiliki elektron valensi paling banyak (8 elektron). Oleh karena itu, untuk mengeluarkan elektron valensi dari atom gas mulia memerlukan energi ionisasi yang sangat besar.
3. Afinitas Elektron
Afinitas elektron adalah perubahan energi atom ketika elektron ditambahkan kepada atom itu dalam keadaan gas. Contoh:
Berbeda dengan energi ionisasi, afinitas elektron dapat berharga positif atau negatif. Jika satu elektron ditambahkan kepada atom yang stabil dan sejumlah energi diserap maka afinitas elektronnya berharga positif. Jika dilepaskan energi, afinitas elektronnya berharga negatif.

Secara umum, nilai afinitas elektron dalam golongan yang sama dari atas ke bawah menurun, sedangkan pada periode yang sama dari kiri ke kanan meningkat. Nilai afinitas elektron umumnya sejalan dengan jarijari atom. Makin kecil jari-jari atom, nilai afinitas elektron makin tinggi. Sebaliknya, makin besar jari-jari atom, nilai afinitas elektron kecil.
4. Keelektronegatifan Atom
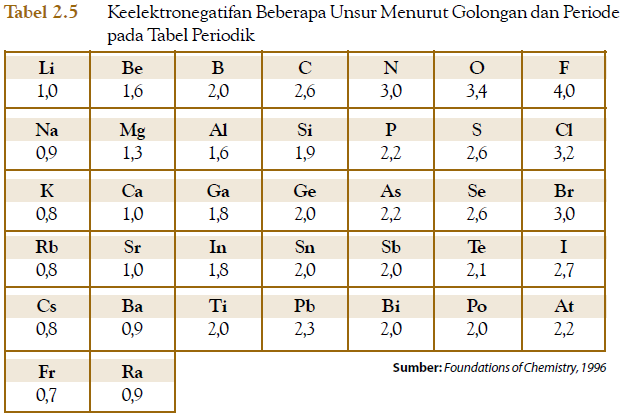
Keelektronegatifan didefinisikan sebagai kecenderungan suatu atom dalam molekul untuk menarik pasangan elektron yang digunakan pada ikatan ke arah atom bersangkutan. Skala keelektronegatifan yang dipakai sampai sekarang adalah yang dikembangkan oleh Pauling sebab lebih lengkap dibandingkan skala keelektronegatifan yang lain. Pauling memberikan skala keelektronegatifan 4 untuk unsur yang memiliki energi ionisasi dan energi afinitas elektron tinggi, yaitu pada unsur florin, sedangkan unsur-unsur lainnya di bawah nilai 4.
Pada tabel periodik, unsur florin yang ditetapkan memiliki keelektronegatifan 4 (terbesar) berada di ujung kanan paling atas. Adapun Unsur fransium yang memiliki keelektronegatifan terendah yaitu 0,7 berada di kiri paling bawah dalam tabel periodik.
Contoh 2.7
Menentukan Kecenderungan Skala Keelektronegatifan Nomor atom unsur X, Y, dan Z berturut-turut adalah 11, 15, dan 20. Urutkan unsurunsur tersebut berdasarkan kenaikan skala keelektronegatifannya.
Jawab
Unsur-unsur tersebut berada pada golongan dan periode sebagai berikut:
X: golongan IA dan periode ke-3
Y: golongan VA dan periode ke-3
Z: golongan IIA dan periode ke-4
Berdasarkan data pada Tabel 2.5, skala keelektronegatifan X = Na, Y = P, dan Z = Ca. Jadi, urutan skala keelektronegatifannya adalah X < Z < Y.


















0 comments:
Post a Comment